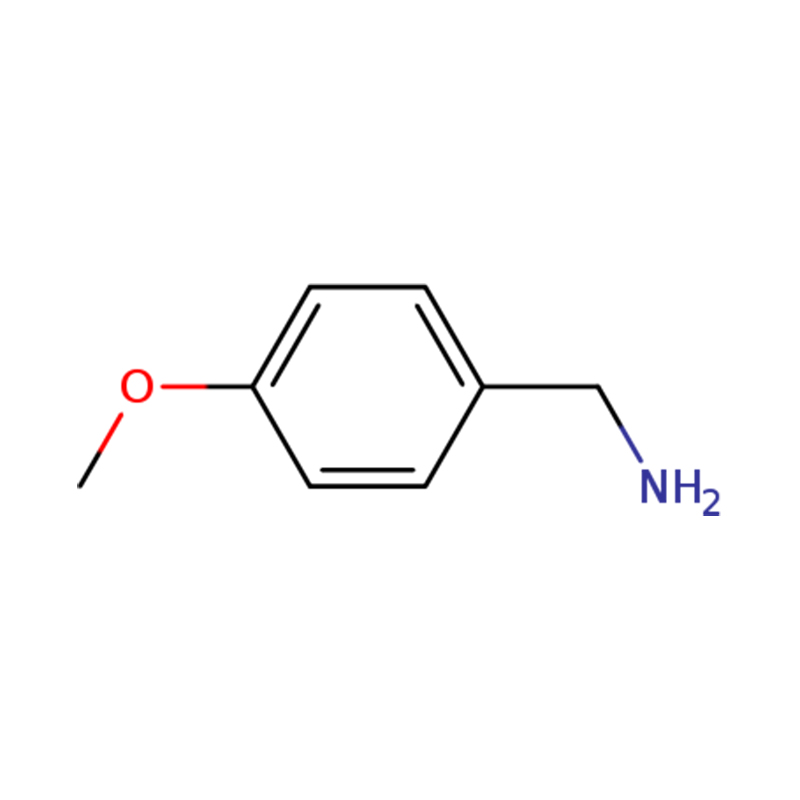
1-(4-Methoxyphenyl)methanamin
Produktdetails
| CasNo | 2393-23-9 | Lieferzeit | innerhalb von 10 Tagen |
| Molekular | C8H11NO | Produktionskapazität | 1 Tonne/Tag |
| Aussehen | Klare, farblose bis leicht gelbliche Flüssigkeit | Reinheit | 99%min |
| Anwendung | Pharmazeutische Zwischenprodukte | Lagerung | Raumtemperatur, dunkel, luftdicht verschlossen |
| LimitNum | 1 Kilogramm | Transport | Luft, See, Express. |
| Dichte | 1,05 g/ml bei 25 °C (Lit.) | Siedepunkt | 236-237°C (Lit.) |
| Schmelzpunkt | -10°C | Brechungsindex | n20/D1.546(lit.) |
| Flammpunkt: | >230°F | Löslichkeit | Sehr gut löslich in Wasser |
| Name | p-Anisylamin oder (4-Methoxyphenyl)methanamin |
Synonyme
LABOTEST-BB LTBB000703; AKOS BBS-00003589; 4-Aminomethylanisol; 4-Methoxybenzylamin; p-Methoxybenzylaminhydrochlorid 173,64; 4-Methoxybenzylamin, 98+%; für Sparfloxacin; p-Methoxybenzylaminhydrochlorid
Anwendung
Es kann zur Synthese pharmazeutischer Zwischenprodukte verwendet werden. Es ist leicht wasserschädlich. Unverdünntes oder größeres Produkt darf nicht mit Grundwasser, Gewässern oder Abwassersystemen in Berührung kommen. Ohne behördliche Genehmigung dürfen keine Stoffe in die Umwelt eingeleitet werden, um den Kontakt mit Oxiden, Säuren, Luft und Kohlendioxid zu vermeiden. Behälter dicht verschlossen halten, in einen luftdichten Behälter stellen und kühl und trocken lagern.
QC-Labor
Auf dem Gelände befindet sich ein separates Qualitätskontrolllabor, in dem chemische, physikalische und mikrobiologische Prüfungen, Stabilitätsstudien sowie instrumentelle Tests (z. B. IR, UV, HPLC, GC) an Rohstoffen und Fertigprodukten durchgeführt werden. Der gesamte Bereich ist zugangskontrolliert und wird sorgfältig gewartet. Er verfügt über ausreichend Analysegeräte für die jeweiligen Prüfzwecke. Alle Geräte sind ordnungsgemäß beschriftet und kalibriert.
QA
Die Qualitätssicherung (QS) ist für die Bewertung und Kategorisierung von Abweichungen in die Kategorien „Schwerwiegend“, „Mittel“ und „Geringfügig“ verantwortlich. Für alle Abweichungsstufen ist eine Untersuchung zur Ermittlung der Hauptursache bzw. potenziellen Ursache erforderlich. Die Untersuchung muss innerhalb von sieben Werktagen abgeschlossen sein. Nach Abschluss der Untersuchung und Ermittlung der Hauptursache sind außerdem eine Produktfolgenabschätzung sowie ein CAPA-Plan (Corrective and Preventive Action) erforderlich. Die Abweichung gilt als abgeschlossen, sobald die CAPA-Maßnahmen umgesetzt wurden. Alle Abweichungsstufen bedürfen der Genehmigung durch den QS-Manager. Nach der Umsetzung wird die Wirksamkeit der CAPA-Maßnahmen anhand des Plans überprüft.