Hintergrund und Studiendesign
Retatrutid (LY3437943) ist ein neuartiges Einzelpeptid-Medikament, das aktiviertdrei Rezeptoren gleichzeitigGIP, GLP-1 und Glucagon. Zur Bewertung der Wirksamkeit und Sicherheit bei übergewichtigen Personen ohne Diabetes wurde eine randomisierte, doppelblinde, placebokontrollierte Phase-II-Studie durchgeführt (NCT04881760). Insgesamt nahmen338 TeilnehmerPatienten mit einem BMI ≥ 30 oder ≥ 27 mit mindestens einer gewichtsbedingten Begleiterkrankung wurden randomisiert und erhielten entweder Placebo oder Retatrutid (1 mg, 4 mg mit zwei Titrationsschemata, 8 mg mit zwei Titrationsschemata oder 12 mg), das einmal wöchentlich über 48 Wochen subkutan verabreicht wurde.primärer EndpunktDer primäre Endpunkt war die prozentuale Veränderung des Körpergewichts in der 24. Woche, wobei die sekundären Endpunkte die Gewichtsveränderung in der 48. Woche und kategorische Gewichtsverlustschwellenwerte (≥5 %, ≥10 %, ≥15 %) umfassten.
Wichtigste Ergebnisse
-
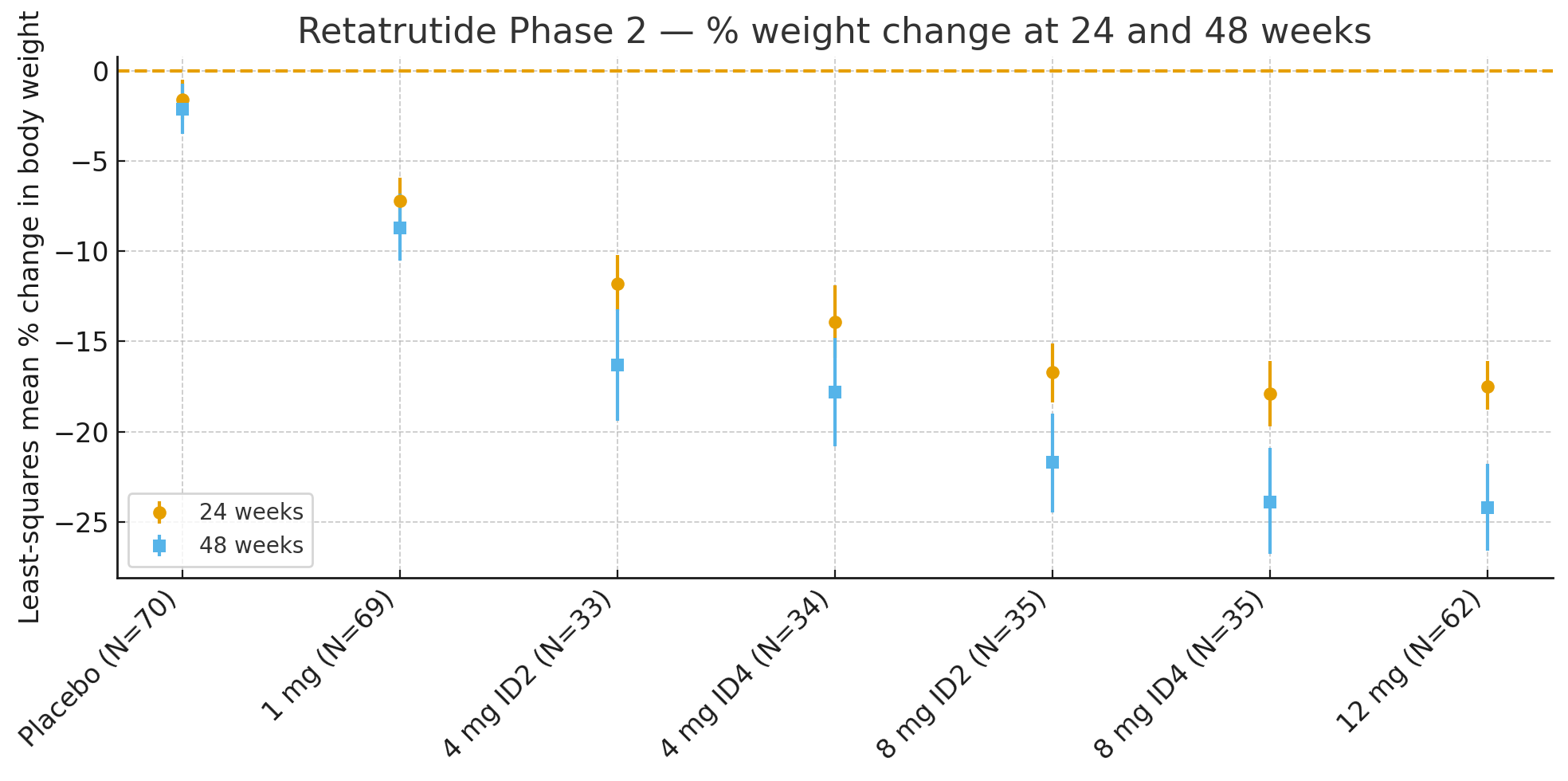
24 WochenDie mittlere prozentuale Veränderung des Körpergewichts im Vergleich zum Ausgangswert (Methode der kleinsten Quadrate) betrug
-
Placebo: −1,6 %
-
1 mg: −7,2 %
-
4 mg (kombiniert): −12,9 %
-
8 mg (kombiniert): −17,3 %
-
12 mg: −17,5 %
-
-
48 WochenDie prozentuale Veränderung des Körpergewichts betrug
-
Placebo: −2,1 %
-
1 mg: −8,7 %
-
4 mg (kombiniert): −17,1 %
-
8 mg (kombiniert): −22,8 %
-
12 mg: −24,2 %
-
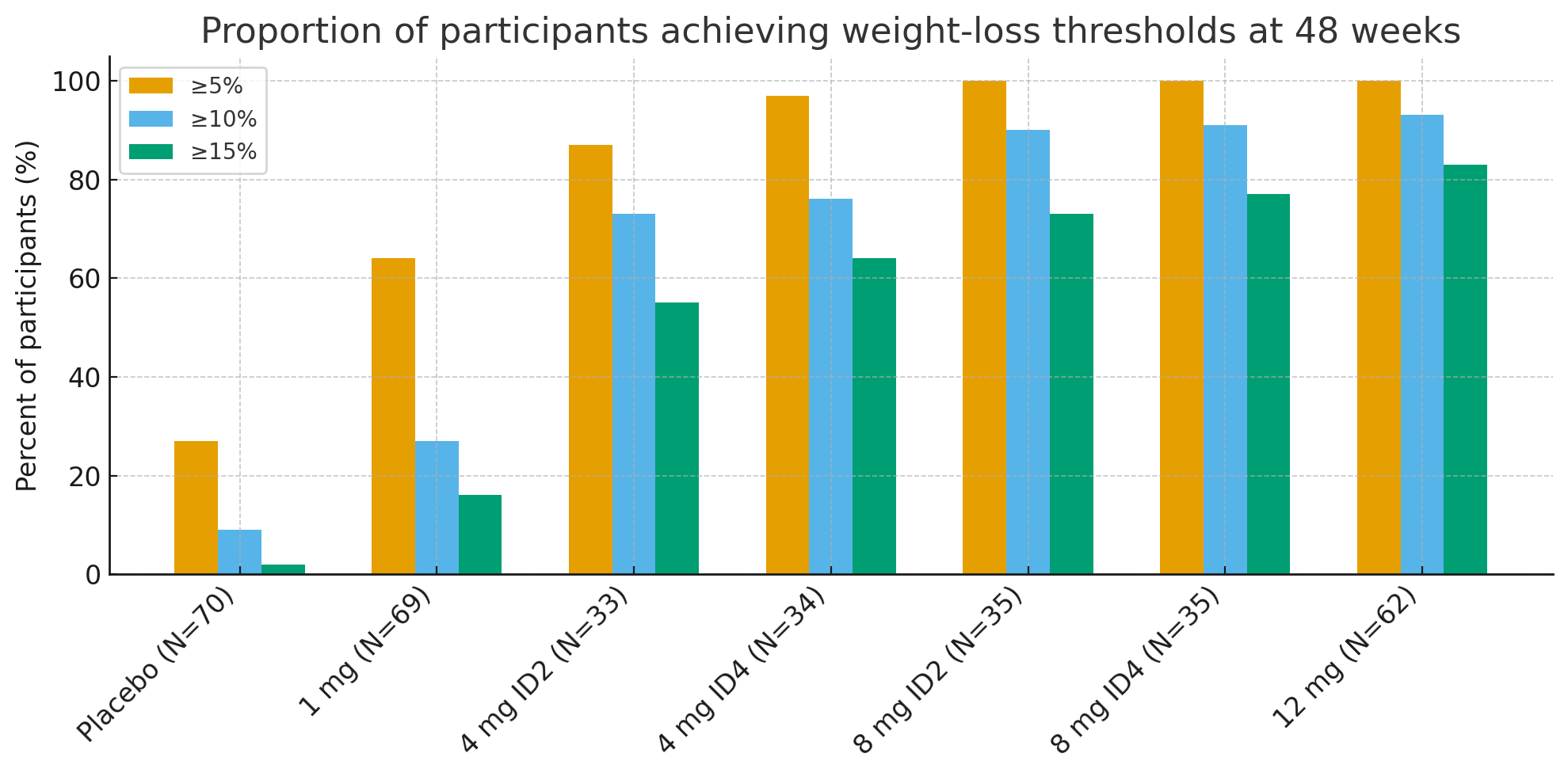
Nach 48 Wochen waren die Anteile der Teilnehmer, die klinisch relevante Gewichtsverlustschwellenwerte erreichten, bemerkenswert:
-
Gewichtsverlust von ≥5 %: 27 % unter Placebo gegenüber 92–100 % in den aktiven Gruppen
-
≥10 %: 9 % unter Placebo gegenüber 73–93 % in den aktiven Gruppen
-
≥15 %: 2 % unter Placebo gegenüber 55–83 % in den aktiven Gruppen
In der 12-mg-Gruppe bis zu26 % der Teilnehmer verloren ≥30 % ihres Ausgangsgewichts, ein Gewichtsverlust in vergleichbarem Ausmaß wie bei einer bariatrischen Operation.
Sicherheit
Die häufigsten Nebenwirkungen betrafen den Magen-Darm-Trakt (Übelkeit, Erbrechen, Durchfall), waren im Allgemeinen leicht bis mittelschwer und dosisabhängig. Niedrigere Anfangsdosen (2-mg-Titration) reduzierten diese Nebenwirkungen. Dosisabhängige Anstiege der Herzfrequenz wurden beobachtet, die in Woche 24 ihren Höhepunkt erreichten und anschließend wieder abfielen. Die Abbruchraten lagen in den verschiedenen Wirkstoffgruppen zwischen 6 und 16 % und damit etwas höher als unter Placebo.
Schlussfolgerungen
Bei übergewichtigen Erwachsenen ohne Diabetes führte die wöchentliche subkutane Gabe von Retatrutid über 48 Wochen zuerhebliche, dosisabhängige Reduktionen des Körpergewichts(bis zu ca. 24 % mittlerer Gewichtsverlust bei der höchsten Dosis) sowie Verbesserungen der kardiometabolischen Marker. Gastrointestinale Nebenwirkungen traten häufig auf, waren aber durch Dosisanpassung beherrschbar. Diese Ergebnisse der Phase 2 deuten darauf hin, dass Retatrutid einen neuen therapeutischen Standard für Adipositas darstellen könnte, vorbehaltlich der Bestätigung in größeren, langfristigen Phase-3-Studien.
Veröffentlichungsdatum: 28. September 2025